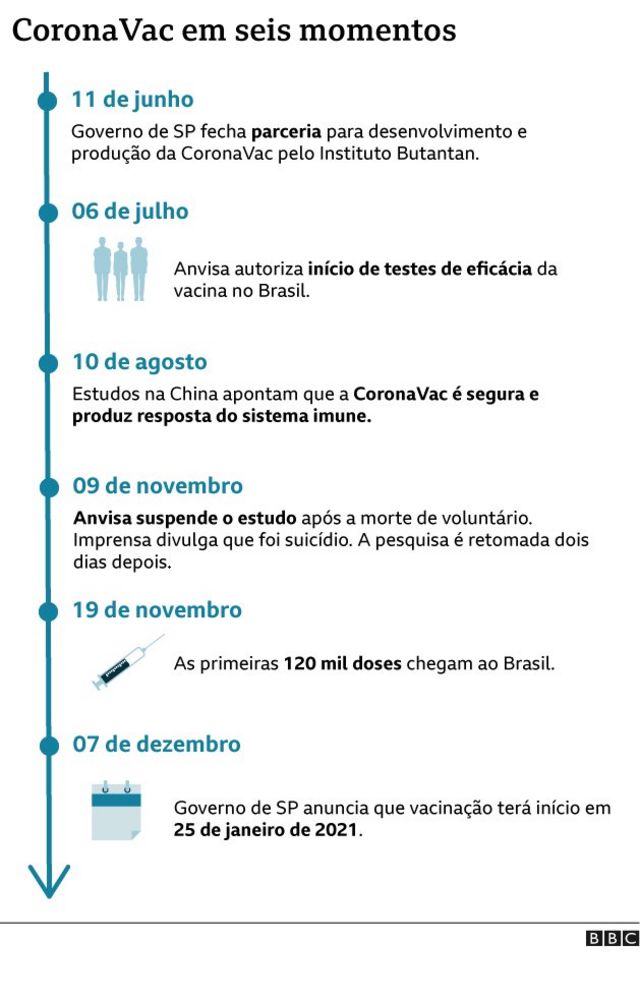
Os estudos apontaram que esta vacina protege 78% das pessoas que a tomam contra a covid-19, a doença causada pelo novo coronavírus.
Segundo o governo, a vacina garantiu a proteção total (100%) contra mortes, casos graves e internações nos voluntários vacinados que foram contaminados.
As duas etapas anteriores da pesquisa feitas no Brasil já haviam atestado que a CoronaVac é segura e produz uma resposta do sistema imunológico.
A fase 3 da pesquisa investigava se ela de fato impedia que uma pessoa ficasse doente ao ser infectada pelo Sars-Cov-2.
Originalmente, o governo paulista previa divulgar uma análise preliminar da eficácia em 15 de dezembro, mas concluiu que já tinha condições de fazer uma análise completa dos resultados, porque já tinha ao menos 170 voluntários com casos de covid-19 confirmados, um parâmetro estabelecido pelo protocolo do estudo, e adiou o anúncio para janeiro.
Com base nesta série de resultados, o governo paulista e o Butantan devem enviar à Agência Nacional de Vigilância Sanitária (Anvisa), ainda nesta quinta, o pedido de autorização para o uso emergencial e o registro definitivo da vacina no país. A previsão é de que os dados sejam analisados em dez dias.
Em 21 de dezembro, a agência já havia feito a certificação da fábrica da Coronavac na China, após fazer uma inspeção nas instalações. Este é um dos pré-requisitos para o registro da vacina no Brasil.
Obter o aval da agência será fundamental para que o governo de João Doria (PSDB) consiga colocar em prática o plano de vacinação no Estado de São Paulo, com previsão de início em 25 de janeiro.
Simultaneamente, a Sinovac deverá pedir o registro da vacina à Administração Nacional de Produtos Médicos, a equivalente da Anvisa na China. A expectativa é que o registro seja concedido em três dias.
Isso deverá pressionar a agência brasileira, porque a lei 13.979 obriga a Anvisa a conceder autorização “excepcional e temporária” para medicamentos considerados essenciais no combate à pandemia que tenham sido registrados pela agências do Japão, da China, dos Estados Unidos ou da Europa.
A autorização tem que ser concedida até em 72 horas após o pedido ser feito à agência brasileira. Caso a Anvisa não se manifeste, isso ocorre automaticamente. O prazo normal para análise de registro permanente de vacinas contra a covid-19 é de até 60 dias.
Esse trecho da lei chegou a ser vetado pelo presidente Jair Bolsonaro (sem partido), mas o veto foi derrubado pelo Congresso Nacional.
O entendimento da lei foi ratificado pelo ministro Ricardo Lewandowski, do Supremo Tribunal Federal (STF), que concedeu uma liminar neste sentido em 17 de dezembro. A questão ainda será apreciada pelo plenário da Corte.
A BBC News Brasil preparou a seguir uma reportagem especial para explicar tudo que se sabe até agora sobre a CoronaVac. Confira.

O que dizem as pesquisas
Os estudos da vacina da Sinovac começaram a ser feitos no início de maio na China.
As duas primeiras fases investigaram se o imunizante é seguro e se consegue gerar uma resposta do sistema imunológico. Ao todo, participaram 743 voluntários, com idades entre 18 e 59 anos.
A CoronaVac teve bons resultados em ambos os critérios. Os resultados foram divulgados no início de agosto e publicados na revista The Lancet, uma das mais prestigiadas do meio científico, em meados de novembro.
A pesquisa testou duas dosagens do imunizante, uma mais baixa (3µg) e outra mais alta (6 ug) e concluiu que a aplicação da menor dose era a mais indicada.
Dentre os que tomaram essa dose, 97% apresentaram uma resposta imunológica, ou seja, a vacina induziu à produção de anticorpos, que foram detectados no organismo até 28 dias depois da aplicação da segunda dose da vacina, prazo limite de avaliação usado no estudo.
O estudo concluiu que a vacina é segura ao apontar que nenhum efeito colateral grave relacionado à vacina foi identificado dentro dos 28 dias em nenhuma das duas fases da pesquisa.
A taxa de eventos adversos entre os participantes variou entre 13% e 38%, conforme a fase do estudo, a dose tomada e o momento em que a avaliação foi feita.
A maioria dos eventos adversos foram leves, sendo o mais frequente dor no local da injeção, e os pacientes se recuperaram em até 48 horas.
A segurança da vacina foi atestada também pelos estudos de eficácia realizados no Brasil com 9 mil voluntários nacionais.
Resultados preliminares divulgados no final de outubro apontaram que 35% dos participantes tiveram efeitos adversos.
Os mais comuns foram dor, edema e inchaço no local da aplicação, dor de cabeça e fadiga. Não foram detectados efeitos colaterais graves.
Agora, os resultados da investigação da eficácia da CoronaVac apontam 78% das pessoas que tomam a vacina ficam protegidas contra a covid-19. A taxa mínima recomendada pela Organização Mundial da Saúde (OMS) e pela Anvisa é de 50%.


Quais são as vantagens e desvantagens da tecnologia da CoronaVac?
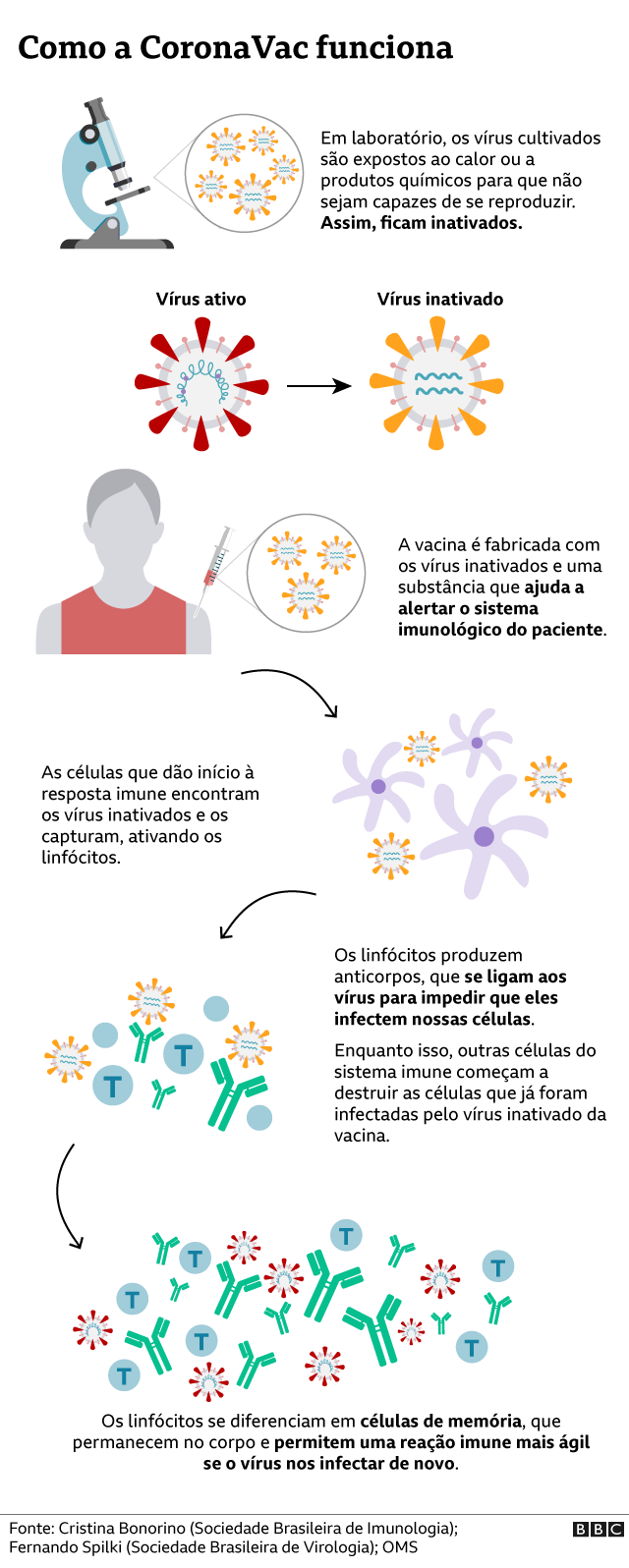
A vacina da Sinovac usa uma tecnologia bastante tradicional de imunização, desenvolvida há cerca de 70 anos, diz o imunologista Aguinaldo Pinto, professor da Universidade Federal de Santa Catarina.
“Não há nada de novo na tecnologia por trás dessa vacina. Temos muitas vacinas de vírus inativados sendo comercializadas hoje”, afirma Pinto.
Entre as que tomamos de rotina que utilizam essa tecnologia, estão as de gripe, hepatite A e poliomielite (na versão injetável).
A seu favor, conta a experiência de décadas no seu uso em saúde pública.
E também sua segurança, porque é um imunizante baseado em vírus inativados, ou seja, que não são capazes de se reproduzir. Por isso, eles não conseguem deixar uma pessoa doente.
Mesmo assim, a vacina consegue gerar a reação imunológica desejada e criar no nosso organismo uma memória de como nos defender contra essa ameaça.
No caso da CoronaVac, são aplicadas duas doses, com uma diferença de 21 dias entre elas.
Mas vacinas com essa tecnologia são mais caras para serem produzidas, porque é necessário cultivar uma grande quantidade de vírus em laboratório, que devem então ser submetidos ao processo de inativação.
Além disso, elas não precisam ser armazenadas em temperaturas extremamente baixas, como é o caso a vacina da Pfizer e da Moderna, que devem ser mantidas a -70ºC e -20ºC respectivamente para durarem mais tempo.
A CoronaVac é armazenada e transportada a uma temperatura de refrigeradores comuns, entre 2ºC e 8ºC, o que facilita a logística de um plano de imunização.



Como a eficácia da CoronaVac se compara às de outras vacinas
Pfizer/BioNTech: 95%
eResultados divulgados em 18 de novembro apontaram ainda uma eficácia de mais de 94% em idosos. Esta vacina usa uma tecnologia inédita baseada em RNA mensageiro. O estudo de fase 3 ainda não foi publicado em revista científica.
Moderna: 94,1%
De acordo com os resultados anunciados no dia 30 de novembro, nenhum caso grave de covid-19 entre os participantes que tomaram as duas doses do imunizante. Também é uma vacina baseada em RNA mensageiro.
AstraZeneca/Oxford: 62% a 90%
O estudo aferiu uma eficácia média de 70%. Mas identificou uma taxa menor, de 62%, quando aplicadas duas doses completas, e maior, de 90%, com o uso de meia dose e depois uma dose completa. Esta vacina usa uma tecnologia de imunização baseada em um vetor viral não replicante. Os resultados foram publicados em 8 de dezembro na revista The Lancet.
Sputnik V: 91,4%
O estudo ainda apontou uma eficácia de 100% na prevenção de casos graves de covid-19. Esta vacina usa um vetor viral não replicante. Os resultados, divulgados pelo Centro Gamaleya e o Fundo para Investimentos Diretos da Rússia em 24 de novembro, ainda não foram publicados em uma revista científica.
Sinopharm: 86%
A taxa foi identificada em uma análise preliminar de estudos da farmacêutica chinesa feitas nos Emirados Árabes. De acordo com o ministério da Saúde do país, o imunizante levou à produção de anticorpos em 99% dos participantes e que não “houve preocupações sérias quanto à segurança”, segundo a agência estatal WAM. A vacina também apresentou 100% de eficácia na prevenção de casos leves e graves de covid-19. Não foram divulgados detalhes dos resultados, ainda não publicados em revista científica. Baseado em vírus inativado, o imunizante recebeu uma autorização de uso emergencial no país.


Como é feita a produção pelo Butantan?
O instituto começou a produzir a vacina em 9 de dezembro. “É a primeira vacina contra a covid-19 produzida no Brasil”, disse Dimas Covas, diretor do Butantan, ao anunciar a fabricação.
O Butantan adotou desde então um regime de trabalho intensivo para ter prontas em janeiro 40 milhões das 46 milhões de doses que o governo de São Paulo espera ter em mãos em janeiro.
Outras 6 milhões são importadas da China, das quais 4,22 milhões já chegaram ao Brasil.
O instituto anunciou que a produção está ocorrendo em turnos sucessivos, sete dias por semana, para que a produção diária alcance a capacidade de 1 milhão de doses por dia.
Desta forma, a fábrica funciona sem parar, 24 horas por dia, para dar conta da demanda. Até outubro, a operação era de segunda a sexta-feira, em dois turnos.
A força de trabalho também foi ampliada em 50% para dar conta da demanda.

Como será a vacinação em SP
O governo de São Paulo anunciou em 7 de dezembro que a vacinação com a CoronaVac terá início em 25 de janeiro, embora ela não tenha sido aprovada ainda pela Anvisa.
Por enquanto, foram anunciados os detalhes apenas da primeira fase do plano de imunização, que tem como público-alvo profissionais de saúde, pessoas com mais de 60 anos, indígenas e quilombolas.
De acordo com o governo paulista, estes grupos respondem por 77% das mortes causadas pelo novo coronavírus no Estado.
Isso implicará na vacinação de 9 milhões de pessoas e no uso de 18 milhões de doses.
A vacinação será gratuita e realizada por meio de 10 mil postos de vacinação, dos quais 4,8 mil serão novos locais, criados especialmente para a campanha, com o uso provisório de escolas, quartéis e farmácias, por exemplo.
Na quarta-feira (06/01), o governo de São Paulo divulgou que a vacinação ocorrerá de segunda a sexta, das 7h às 22h, e de 7h às 17h aos sábados, domingos e feriados.
A previsão é que a primeira fase do plano esteja concluída até 28 de março, quando o governo paulista estima que 20% dos 46 milhões de habitantes do Estado estarão imunizados.
A primeira fase do plano seguirá o seguinte calendário, para evitar aglomerações nos postos de saúde:
* profissionais da Saúde, indígenas e quilombolas: 25/01 (1ª dose) e 15/02 (2ª dose);
* pessoas com 75 anos ou mais: 08/02 (1ª dose) e 01/03 (2ª dose);
* pessoas com 70 a 74 anos: 15/02 (1ª dose) e 03/03 (2ª dose);
* pessoas com 65 a 69 anos: 22/02 (1ª dose) e 15/03 (2ª dose)
* pessoas com 60 a 64 anos: 01/03 (1ª dose) e 22/03 (2ª dose)
Cada grupo deverá procurar os postos de vacinação ao longo da semana seguinte após a data de início. O atendimento será das 7h às 22h de segunda a sexta e das 7h às 17h aos sábados, domingos e feriados.
Tudo será feito apenas pelo sistema público de saúde, e não há previsão por enquanto de aplicação na rede privada.
O governador João Doria disse que não será preciso comprovar a residência no Estado para ser vacinado. “Todo e qualquer brasileiro que estiver em solo do Estado e pedir a vacina será vacinado”, afirmou.
Ainda não foram divulgados detalhes sobre as próximas etapas do plano de imunização.

A CoronaVac vai estar disponível em outros locais do país?
É provável que sim. Mas as condições em que isso vai acontecer ainda são incertas.
O governo de São Paulo disse que disponibilizará 4 milhões das 46 milhões de doses já compradas para que outros Estados imunizem profissionais de saúde.
De acordo com Doria, 11 já manifestaram interesse: Acre, Ceará, Espírito Santo, Maranhão, Mato Grosso do Sul, Pará, Piauí, Paraíba, Rio Grande do Norte, Rio Grande do Sul e Roraima.
Doria também informou que mais de 900 municípios já manifestaram interesse na vacina, mas a relação não foi divulgada.
Por sua vez, o ministro da Saúde, o general Eduardo Pazuello, chegou a anunciar no final de outubro a compra de 46 milhões doses da CoronaVac.
Mas foi no dia seguinte desautorizado pelo presidente Jair Bolsonaro (sem partido) em uma mensagem pelo Facebook na qual disse que, como o imunizante ainda não tinha sido autorizado pela Anvisa, sua decisão era de “não adquirir a referida vacina”.
Bolsonaro e Doria são adversários políticos e provavelmente se enfrentarão nas urnas em 2022.
Questionado por Doria em uma reunião com governadores em 8 de dezembro, Pazuello disse que compraria a CoronaVac, uma vez que ela esteja registrada na Anvisa, “se houver demanda e houver preço”.
Ao lançar o plano oficial no último dia 16, o Ministério da Saúde indicou que havia uma intenção de compra da Coronavac, mas não especificou a princípio quantas doses pretendia adquirir.
No dia seguinte, Pazuello informou que o plano prevê receber 9 milhões de doses da CoronaVac em janeiro e 22 milhões em fevereiro.
Ainda não há uma data prevista para o início da campanha nacional de imunização contra a covid-19.

Vai ser obrigatório tomar a vacina?
João Doria disse em meados de outubro que a vacina contra a covid-19 seria obrigatória em todo o Estado de São Paulo. Segundo o governador, somente quem tiver um atestado médico que comprove que ele não pode ser imunizado seria liberado.
“Adotaremos medidas legais se houver contrariedade nesse sentido”, disse o governador na época.
No mesmo dia, Bolsonaro afirmou que quem ofereceria vacinas contra a covid-19 seria o Ministério da Saúde, mas “sem impor ou tornar a vacina obrigatória”.
Em meio a esse embate, o Supremo Tribunal Federal (STF) se manifestou sobre o assunto ao julgar duas ações levadas à corte relativas à lei criada em fevereiro que prevê medidas de combate à pandemia, entre elas a possibilidade de vacinação obrigatória.
Uma era movida pelo PDT, que pede que o STF reconheça o direito de Estados e municípios de impor a vacinação. Outra, pelo PTB, defende que essa possibilidade é inconstitucional. Ambas são relatadas pelo ministro Ricardo Lewandowski.
O STF decidiu por ampla maioria no último dia 17 que União, Estados e municípios podem adotar medidas para obrigar a população a se vacinar, mas não poderão forçar fisicamente as pessoas a fazer isso.
A Corte autorizou no entanto que sejam adotadas sanções indiretas, como proibir os não vacinados de frequentar certos lugares ou exercer determinadas atividades.
Eles ressaltaram que a vacinação generalizada da população é necessária para reduzir a circulação do coronavírus, salvando vidas. Já são mais de 180 mil mortos pela covid-19 no Brasil.
Ao comentar a decisão, Bolsonaro disse que o governo federal não tomará medidas contra quem não quiser se vacinar e que a decisão do Supremo pode ser “inócua”, porque “não vai ter vacina para todo mundo”.
Doria não se manifestou sobre o assunto desde a decisão do STF.









0 Comentários